Вирус гриппа имеет липопротеиновую оболочку, на поверхности которой находятся белок гемагглютипина, нейраминидаза и N-конец М2-белка.
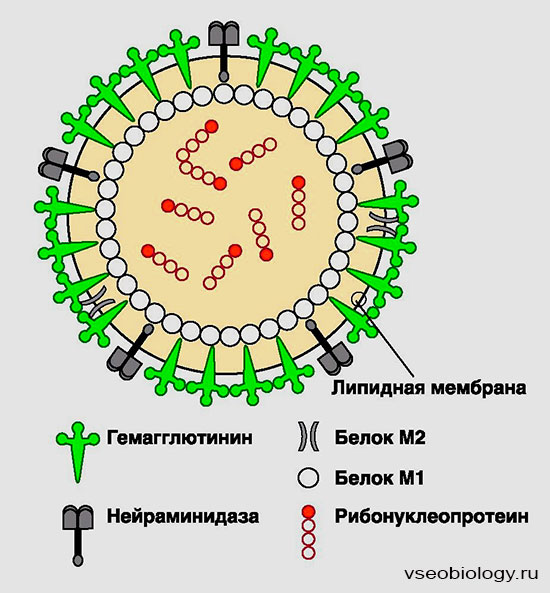
Основной белок этого вируса, ответственный за появление протективных антител, — гемагглютинин. При синтезе в клетке животных он подвергается модификации (гликозилированию, специфическому расщеплению на два фрагмента НА1 и НА2, удерживаемых вместе дисульфидными связями) и в вирионах существует в форме стабильной субъединицы триммера. Нативный гемагглютинин имеет форму встроенных гантелевидных структур с большой головкой, обращенной наружу, и малой головкой, погруженной в липидную мембрану вириона. На большой головке локализованы две последовательные антигенные детерминанты (А и В) и две конформационные детерминанты (С и D). Изолированный гемагглютинин значительно слабее стимулирует клоны Т-лимфоцитов из-за отсутствия в препаратах М2-белка либо по другим причинам.
Многочисленные попытки создать гриппозную субъединичную вакцину, или так называемую сплит-вакцину, на основе изолированного гемагглютинина не дали удовлетворительных результатов. Мономерный гемагглютинин, полученный микробиологическим синтезом на матрице рекомбинантной ДНК и лишенный гликозилирования, почти не иммуногенен. Гликозилирование капсидных вирусных белков влияет на их физическую стабильность, антигенные свойства и, возможно, на способность к взаимодействию с липидами, что определяет в некоторых случаях возникновение мультимерных форм белка.










