Все началось в далеком 19 веке. В 1890 г. Э. Беринг и С. Китасато установили, что сыворотки кроликов, которым вводили дифтерийный токсин, приобретали способность нейтрализовать этот токсин и оказывать лечебное действие при дифтерийной инфекции. Так были открыты антитела.
Примерно в это же время, в конце 19 века, Пауль Эрлих установил, что антитела, отвечающие за иммунные реакции, имеют на своей поверхности специальные рецепторы, с помощью которых они прикрепляются к чужеродному объекту и связывают его. Он установил присутствие в плазме крови особых белков, способных нейтрализовать микробные тела (отсюда название – антитела, т.е. факторы против микробных тел). За обоснование гуморальной теории иммунитета П. Эрлих получил Нобелевскую премию в 1908 году.
В 1952 году О. Брутон впервые в мире описал клинический случай агаммаглобулинемии у людей (болезни отсутствия антител) и успешно апробировал заместительную терапию γ-глобулином, полученным из сыворотки крови здоровых доноров.
Всем известный термин «иммуноглобулины» предложил Дж. Хереманс в 1959 году. Это название оказалось весьма удачным, потому вмещало в себя и структурную, и функциональную характеристику антител. Позже Джеральд Эдельман и Родни Портер расшифровали химическую структуру антител, за что в 1972 году получили Нобелевскую премию.
В дальнейшем Нельс Эрне, Цезарь Мильштейн и Георг Келлер обосновали теорию идиотипической цепи (идиотип – участок антитела, ответственный за специфическое взаимодействие с антигеном), а также разработали методику получения гибридом, что позволило синтезировать моноклональные антитела к разнообразным молекулам. С тех пор моноклональные иммуноглобулины с успехом используются для диагностики и лечения многих болезней человека. За эти открытия учёные получили Нобелевскую премию в 1984 году.
Исследователь Сусуми Тонегава открыл механизм формирования неограниченного разнообразия антител, который получил название реаранжировки генов иммуноглобулинов. Стало ясно, что человеческий организм приспосабливается к условиям окружающей среды не только фенотипически, но и на генотипическом уровне. Молекулярной основой такой адаптации является пожизненное формирование новых генов антигенс-вязывающих сайтов иммуноглобулинов путём запуска процессов рекомбинативной изменчивости. В 1987 году С. Тонегава удостоен Нобелевской премии по физиологии и медицине.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Не сложно заметить, что за работы в области изучения антител уже получены 4 Нобелевские премии. Данный случай - уникальный прецедент в работе Нобелевского комитета, поскольку такому количеству наград не удостаивались открытия ни по одной другой теме физиологии и медицины. Это указывает на чрезвычайную важную роль иммуноглобулинов в иммунных процесса.
Антитела (иммуноглобулины, ИГ, Ig) — белковые соединения плазмы крови, образующиеся в ответ на введение в организм человека или теплокровных животных бактерий, вирусов, белковых токсинов и других антигенов. Связываясь активными участками (центрами) с бактериями или вирусами, антитела препятствуют их размножению или нейтрализуют выделяемые ими токсические вещества.
Антитела являются особым классом гликопротеинов, имеющихся на поверхности B-лимфоцитов в виде мембраносвязанных рецепторов и в сыворотке крови. Антитела являются важнейшим фактором специфического гуморального иммунитета. Антитела используются иммунной системой для идентификации и нейтрализации чужеродных объектов — например, бактерий и вирусов.
Антитела выполняют две функции:
- антигенсвязывающую,
- эффекторную (вызывают тот или иной иммунный ответ, например, запускают классическую схему активации комплемента).
Антитела синтезируются плазматическими клетками, которыми становятся некоторые В-лимфоциты, в ответ на присутствие антигенов. Для каждого антигена формируются соответствующие ему специализировавшиеся плазматические клетки, вырабатывающие специфичные для этого антигена антитела. Антитела распознают антигены, связываясь с определённым эпитопом — характерным фрагментом поверхности или линейной аминокислотной цепи антигена.
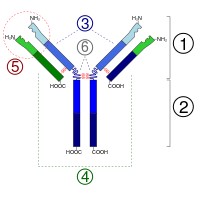
Общий план строения иммуноглобулинов: 1) Fab; 2) Fc; 3) тяжёлая цепь; 4) лёгкая цепь; 5) антиген-связывающийся участок; 6) шарнирный участок
Антитела являются относительно крупными (~150 кДа — IgG) гликопротеинами, имеющими сложное строение. Состоят:
- из двух идентичных тяжёлых цепей (H-цепи, в свою очередь состоящие из VH, CН1, шарнира, CH2- и CH3-доменов),
- из двух идентичных лёгких цепей (L-цепей, состоящих из VL- и CL- доменов).
К тяжёлым цепям ковалентно присоединены олигосахариды. При помощи протеазы папаина антитела можно расщепить на два Fab (англ. fragment antigen binding — антигенсвязывающий фрагмент) и один Fc (англ. fragment crystallizable — фрагмент, способный к кристаллизации). В зависимости от класса и исполняемых функций антитела могут существовать как в мономерной форме (IgG, IgD, IgE, сывороточный IgA), так и в олигомерной форме (димер-секреторный IgA, пентамер — IgM). Всего различают пять типов тяжёлых цепей (α-, γ-, δ-, ε- и μ-цепи) и два типа лёгких цепей (κ-цепь и λ-цепь).
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе










