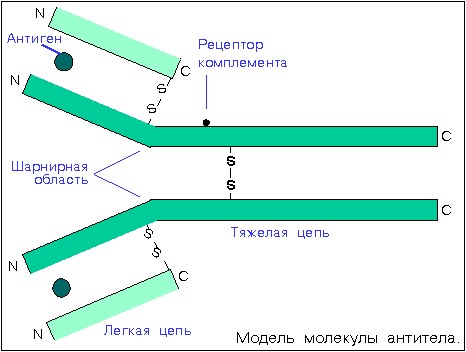
Иммуноглобулины всех классов характеризуются общим планом строения. Молекулы иммуноглобулинов состоит из двух тяжелых (H) и двух легких цепей (L). Каждая легкая цепь соединена с тяжелой цепью нековалентными связями, а также одной ковалентной - дисульфидной связью. Дисульфидным мостиком связаны между собой и тяжелые цепи.
Как легкие, так и тяжелые цепи идентичны. Как видно из рисунка, строение молекулы можно схематично представить в виде буквы Y, где амино- (N-концевые) участки четырех цепей расположены наверху, а карбоксильные (C-концевые) участки тяжелых цепей - внизу. Часть молекулы, включающая в себя дисульфидные связи между тяжелыми цепями, где соединяются три плеча Y, называется шарнирным участком молекулы. Незащищенный шарнирный участок отличается высоким содержанием пролина, имеет протяженную структуру и доступен для протеолитических ферментов.
У человека, как и у большинства позвоночных, легкие цепи существуют в двух различных изотипических формах, обозначенных как каппа-цепь и лямбда-цепь. Обе легкие цепи в одной молекуле иммуноглобулина относятся к одному изотипу. От типа тяжелых цепей зависит принадлежность молекулы Ig к тому или иному классу иммуноглобулинов.
В каждой молекуле иммуноглобулина существует по крайней мере два идентичных антигенсвязывающих центра. Эта бивалентность позволяет антителам перекрестно связывать антигены с двумя или более антигенными детерминантами. Подвижность плеч молекулы антител позволяет ей связываться одновременно с антигенными детерминантами, находящимися на разных расстояниях.
Папаин расщепляет молекулу иммуноглобулина на два одинаковых Fab - фрагмента, каждый из которых имеет один антигенсвязывающий центр и Fc -фрагмент, неспособный связывать антиген.
Пепсин расщепляет молекулу в другом месте, отсекая pFc' -фрагмент от большого 5S -фрагмента, названного F(ab')2, поскольку он, как и исходное антитело, бивалентен в отношении связывания антигена.
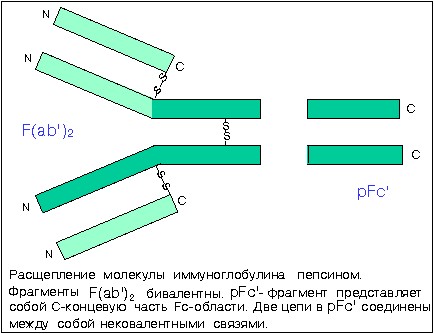
pFc' - фрагмент представляет собой C-концевую часть Fc - области, участок тяжелой цепи в составе Fab-фрагмента обозначают Fd .
Димер пары: легкая цепь - тяжелая цепь (L-H) является основной структурной субъединицей всех классов иммуноглобулинов. Структура иммуноглобулинов разных классов и подклассов различается по числу и расположению дисульфидных связей между тяжелыми цепями, а также по числу (L-H) субъединиц в молекуле.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Исследования показали, что одна часть антитела (Fab-фрагмент) предназначена для связывания с антигеном, а другая часть ( Fc-фрагмент ) взаимодействует с клетками иммунной системы: нейтрофилами, макрофагами и другими мононуклеарными фагоцитами , несущими на своей поверхности рецепторы для Fc-фрагмента. Следовательно, если антитела связались с патогенными микроорганизмами, они могут своим Fc-фрагментом взаимодействовать и с фагоцитами. Благодаря этому клетки возбудителя будут разрушены этими фагоцитами. Фактически антитела действуют в данном случае как молекулы-посредники.
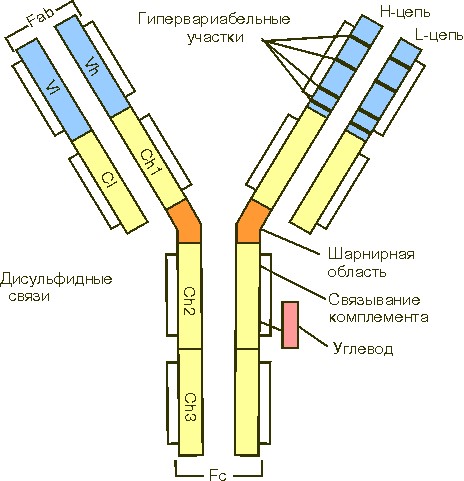
Каждая цепь включает в себя:
- вариабельную (V) область (VL для L-цепей и VH для H-цепей),
- константную (C)область (CL для L-цепей и CH для H-цепей).
От вариабельной области зависит специфичность иммуноглобулинов как антител. В аминокислотной последовательности V-области есть гипервариабельные участки. В V-области легкой цепи имеется три таких участка.
Молекулярная масса легких цепей IgG - 25 кДа, молекулярная масса тяжелых цепей IgG - 50 кДа.
Константная область H-цепи IgG подразделяется на гомологичные участки: CН1, CН2, CН3. L-цепь имеет один константный участок – CL.
Между СН1 и СН2 расположена шарнирная область, обогащенная пролиновыми остатками. (Папаин разрушает иммуноглобулин как раз в шарнирной области, выше межцепьевых дисульфидных связей). Повышенное содержание пролина обеспечивает конформационную гибкость молекулы. Подвижность Fab-фрагмента, необходимая для достаточно успешного взаимодействия с антигенными детерминантами на поверхности клеток, таким образом зависит от шарнирной области.