К основным клеткам, реализующим механизмы врожденного иммунитета, относятся:
- макрофаги,
- нейтрофилы,
- естественные киллеры.
Макрофаги происходят из циркулирующих в крови моноцитов. Макрофаги поглощают и разрушают в основном Гр (–) бактерии, при этом активируются с помощью ЛПС бактерий и вследствие этого начинают секретировать монокины – интерлейкины 1, 6, 8, 12 и TNF-a.
Монокины, выделяемые макрофагами в ответ на бактериальную инфекцию, вызывают следующие эффекты:
- индуцируют продукцию протеинов острой фазы печенью;
- усиливают адаптивный иммунный ответ;
- повышают температуру тела человека;
- индуцируют воспаление, при котором изменяется проницаемость сосудистой стенки, рекрутируются фагоциты, иммунные клетки и молекулы в зону воспаления.
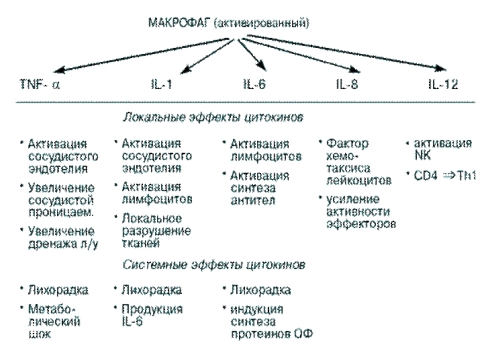
Локальные и системные эффекты монокинов – цитокинов, выделяемых макрофагами
Помимо макрофагов, в реализации механизмов врожденного иммунитета большую роль играют нейтрофилы. Эти клетки преобладают в раннем клеточном инфильтрате в месте воспаления. Они находятся в крови и практически отсутствуют в нормальных тканях. Нейтрофилы – это коротко живущие клетки. В среднем срок их жизни равен 3-4-м дням. При реализации врожденного иммунного ответа продуцируются разные факторы, часть из которых является хемоаттрактантами для нейтрофилов, и они быстро эмигрируют из крови и входят в очаг инфекции. В очаге нейтрофилы способны элиминировать многие патогены путем фагоцитоза.
Нейтрофилы способны фагоцитировать как опсонизированные бактерии, т.е. в соединении с антителами (опсонинами), так и в отсутствии антител. Таким образом, нейтрофилы осуществляют первую линию защиты. Компоненты бактериальной клетки могут быть связаны напрямую с нейтрофилами или опосредовано через липополисахариды – LPS, которые вначале связываются с протеинами сыворотки, образуя липополисахаридсвязанный протеин – LBP. Комплексы LPS и LBP затем соединяются с СД 14 на поверхности нейтрофила. Нейтрофилы могут также фагоцитировать комплексы бактерий, соединенные с С3b компонентом комплемента. Это соединение в свою очередь инициирует альтернативный путь активации комплемента. (С3b – опсонин, С3a С5b – факторы воспаления
Нейтрофилы способны элиминировать Гр(–) и Гр(+) бактерии, грибы и даже некоторые оболочечные вирусы. В то же время многие нейтрофилы погибают в очагах воспаления. Часть микроорганизмов фагоцитируется нейтрофилами, но не убивается ими. Но даже такая секвестрация микроорганизмов важна для хозяйской защиты, так как позволяет контролировать инфекцию в ранний период, а секвестрированные частицы вновь рефагоцитируются другими нейтрофилами или макрофагами, которые аккумулируются в зоне воспаления. Из сказанного следует, что нейтрофилы – это важная составная часть врожденного иммунного ответа хозяина на инфекцию.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Естественные киллеры (NK-клетки) служат в качестве самой ранней защиты против интрацеллюлярных микроорганизмов. NK-клетки были идентифицированы по их способности убивать определенные опухолевые клетки in vitro без предварительной активации. Однако известна их роль в ранней фазе защиты от инфицирования интрацеллюлярными патогенами, особенно Herpes virus и Listeria monocytogenes.
Активность естественных киллеров увеличивается в 20-100 раз, когда на них воздействуют цитокины, в частности, INF-a, INF-b или IL-12.
IL-12 называется также NK-активирующим монокином, который продуцируется в раннюю фазу инфекции. ИЛ-12 в сочетании с INF-a могут вызвать усиление продукции INF-g естественными киллерами.
Поскольку NK-клетки опосредуют в основном защиту человека против вирусов, они должны иметь некие механизмы для дифференцировки инфицированной и неинфицированной клетки. Окончательно этот вопрос не решен, однако установлено, что NK-клетки избирательно убивают клетки-мишени, имеющие низкий уровень молекул MHC класса 1 на своей поверхности. Это предполагает следующий механизм действия NK-клеток: молекулы МНС класса 1 на нормальных клетках распознаются NK-клетками с помощью рецептора Ly49. В результате такого распознавания посылается отрицательный сигнал и происходит ингибиция активации NK-клетки. Иными словами, если рецептор Ly49 на естественных киллерах распознает молекулы МНС класса 1 на поверхности хозяйской клетки, то происходит ингибиция активации NK-клеток и последующего киллинга клетки-мишени не происходит.
Если клетки-мишени не экспрессируют молекулы МНС класса 1, то происходит киллинг их и клетка-мишень погибает. IFN-a и IFN-b усиливают экспрессию молекул МНС класса 1 на поверхности нормальных неинфицированных клеток, тем самым предотвращая атаку на них NK-клеток. Вирус-инфицированные клетки экспрессируют значительно меньшее количество молекул МНС класса 1, либо на их поверхности отсутствуют эти молекулы. В ряде случаев молекулы МНС класса 1 становятся измененными. В этих случаях рецептор Ly49 не распознает молекулы МНС класса 1 (НLA-B аллели) и нет подачи негативного сигнала. В результате NK-клетка активируется и убивает клетку-мишень.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Активация NK-клетки происходит через поверхностный рецептор NK R-P1 – это лектин-подобный рецептор, распознающий карбогидратные молекулы, являющийся триггером киллинга NK-клеток.
С другой стороны, известно, что вирус-инфицированная клетка распознается NK-клеткой даже, когда МНС экспрессия не нарушена вирусом. Люди с дефицитом NK-клеток очень чувствительны к ранней фазе герпес-инфекции.
Подводя итоги, следует сказать, что ранний неадаптивный ответ (врожденный иммунитет) на инфекцию вовлекает широкий круг эффекторных механизмов, направленных на разные классы патогенов. Все ответы становятся возможными благодаря рецепторам, которые являются в основном неспецифичными.










